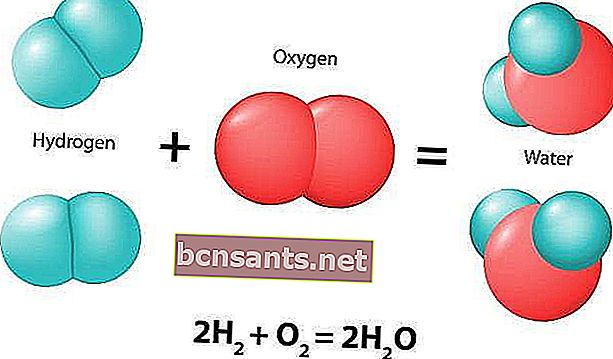
Une réaction chimique est un processus naturel qui produit toujours des changements dans les composés chimiques. Le ou les composés initiaux impliqués dans la réaction sont appelés réactifs.
Les réactions chimiques sont généralement caractérisées par un changement chimique et aboutiront à un ou plusieurs produits qui ont généralement des caractéristiques différentes des réactifs. Voici un exemple de réaction chimique:
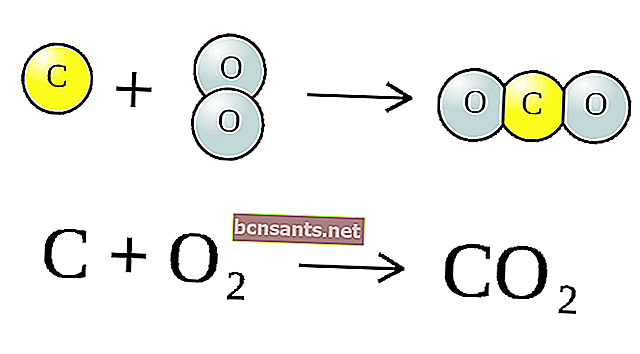
La réaction chimique ci-dessus est une molécule (CO2) constituée d'un atome de carbone (C) et de deux atomes d'oxygène (O) plus un carbone (C), pour produire 2 atomes de monoxyde de carbone (CO).
La combinaison de ces symboles s'appelle l' équation chimique . Les substances à gauche de la flèche sont appelées per-réactions (CO2) et C, et après les flèches sont appelées les produits de réaction, à savoir le CO.
Caractéristiques d'une réaction chimique
Les réactions chimiques dans le monde réel sont très faciles à trouver, par exemple lors de la combustion de papier. Le papier initial se présente toujours sous la forme d'une feuille blanche, après l'avoir brûlé au feu, le papier coloré est brûlé.

D'ailleurs, quand on fait bouillir de l'eau. L'eau liquide suivante devient du gaz et de la vapeur d'eau après avoir été bouillie dans une casserole placée sur la cuisinière.
Ces événements sont le signe d'une véritable réaction chimique. Cependant, pour la formation du produit, le résultat est très difficile à voir. Voici les caractéristiques d'une réaction chimique:
1 . Décoloration
Les molécules / composés chimiques ont la capacité d'absorber la couleur et d'émettre de la couleur en fonction de la substance. Cette capacité peut également être affectée par un événement.
Par exemple: les réactifs de fer qui sont laissés dans un espace ouvert trop longtemps et à l'état humide rouilleront (jaune brunâtre).
2. Changement de température
Les molécules / composés chimiques ont une énergie interne sous forme de liaisons chimiques. Ces liaisons nécessitent de l'énergie ou peuvent libérer de l'énergie.
Lorsque de nombreuses liaisons se forment, de l'énergie est libérée à mesure que la température augmente. Par exemple: brûler du gaz GPL sur la cuisinière
3. L'apparition de bulles de gaz
Des gaz dans les réactions chimiques peuvent se produire en raison du chauffage.
Par exemple: Les molécules / composés de bicarbonate de soude dans la pâte lorsqu'elle est chauffée libèrent du gaz de sorte que le gâteau se dilate.
4. Changement de volume
Lorsque les produits résultant d'une réaction chimique se forment, cela signifie que le volume des réactifs est réduit. Par exemple: Le volume d'eau du lac diminue pendant l'été.
5. Sédiments formés
Un précipité est une réaction chimique résiduelle entre deux solutions qui devient solide. Cette substance peut se produire parce que la solution est trop saturée.
Par exemple: une solution de nitrate d'argent (AgNO3) est ajoutée à une solution contenant du chlorure de potassium (KCl), un précipité blanc de chlorure d'argent (AgCl) se forme.
6. Émission de lumière
Les réactions chimiques libèrent parfois de l'énergie sous forme de lumière
Par exemple: réaction au soleil
7. Changements de conductivité
Les réactions chimiques affectent les changements de conductivité (capacité à conduire la chaleur).
8. Changement de goût
La réaction chimique lors de la mastication du riz crée un goût sucré lorsqu'il touche la langue.
Facteurs affectant

La vitesse de réaction ou la vitesse dans une réaction chimique indique le nombre de réactions chimiques qui ont lieu par unité de temps.
Cette vitesse est influencée par plusieurs facteurs qui peuvent accélérer ou ralentir le processus de réaction. Voici les facteurs.
1. Mesure des réactifs
Du gros sel ou du sel encore en morceaux. Ce gros sel se dissout assez lentement dans l'eau en raison de sa grande taille. De sorte que la réaction chimique dépend beaucoup de la taille de la substance.
Lire aussi: Demande et offre - Définition, lois et exemples2. Température
La température peut affecter les réactions chimiques, notamment par chauffage. Par exemple, en été, les forêts de bois brûlent plus vite que pendant la saison des pluies.
3. Catalyseur
Le catalyseur est une substance qui accélère la vitesse des réactions chimiques à une certaine température, sans subir de changements ni être épuisée par la réaction elle-même. Les enzymes sont un type de catalyseur. Sans enzymes, cette réaction serait trop lente pour que le métabolisme ait lieu.
Par exemple, l'enzyme maltase convertit le maltose (un type de polysaccharide ou de sucre complexe) en glucose. Voici un schéma général des réactions catalytiques, où C représente le catalyseur:
A + C → AC (1)
B + AC → AB + C (2)
Étapes de la réaction chimique
Les étapes de réaction peuvent être facilement divisées en:
- Résiliation des liens,
- Formation de composés de transition
- Formation de liaison
Pour les composés bimoléculaires, les étapes sont plus complexes en raison de la réaction élémentaire.
- Étape d'initiation de la réaction
- Fin des liens
- Formation de composés de transition
- Formation du produit
- Stabilisation d'énergie (en absorbant ou en libérant de l'énergie / généralement de la chaleur)
Divers
Les réactions chimiques sont très diverses, mais peuvent être classées en plusieurs types de réactions, à savoir:
1. Réaction à la fusion
La réaction des deux substances qui se combinent pour former une nouvelle substance. Un exemple simple est la formation du sel NaCl: 2Na + Cl2 → 2NaCl
2. Décomposition de la réaction
Un composé qui se produit dans une réaction chimique se décompose en plus de deux substances. Un exemple est la décomposition de l'eau H2O: 2H2O → 2H2 + O2
3. Réaction d' échange unique
Une réaction d'échange est une réaction dans laquelle un élément réagit avec un composé pour remplacer les éléments contenus dans ce composé. Par exemple, si le cuivre est immergé dans une solution de nitrate d'argent, des cristaux métalliques d'argent sont produits. L'équation de la réaction est:
Cu (s) + 2AgNO 3 (aq) → 2Ag (s) + Cu (NO 3 ) 2 (aq)
4. Réactions d'échange multiples
Habituellement appelée réaction de métathèse, il s'agit d'une réaction d'échange partielle des réactifs. Si le réactif est un composé ionique laurtan, les parties échangées sont les cations et les anions du composé. Par exemple, la réaction d'acides avec des bases telles que:
HCl (aq) + NaOH (aq) → NaCl (aq) + H 2 O (l)
5. Réaction de combustion
Cette réaction peut être connue sous le nom de réaction pour réorganiser les atomes. L'oxygène est l'un des réactifs marqués.
Autrement dit, la réaction de combustion est une réaction chimique d'une substance avec de l'oxygène, réagissant généralement plus rapidement avec la libération de chaleur jusqu'à l'apparition d'une flamme. Par exemple brûler du méthane
CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O (g)
Exemples de réactions chimiques
Il y a tellement de réactions à trouver dans la vraie vie. Certains sont délibérés sous forme de stage en laboratoire afin que cela se produise naturellement.
Certaines de ces réactions chimiques peuvent inclure des réactions d'incorporation dans de nouveaux produits, de combustion, de décomposition et autres. Voici quelques réactions courantes:
1. Formation de savon

La réaction des jeunes arbres est une réaction d'hydrolyse graisse / huile utilisant une base forte telle que NaOH ou KOH pour produire du glycérol et des sels d'acides gras ou du savon. NaOH est utilisé pour produire du savon dur, tandis que KOH est utilisé pour produire du savon doux ou du savon liquide.
La différence entre un savon dur et un savon doux, vu leur solubilité dans l'eau, est que le savon dur est moins soluble dans l'eau que le savon doux. La réaction de saponification est également appelée réaction de saponification.

2. Réaction acide-base au sel
Lisez aussi: 4 principes de géographie et leur application dans nos viesEn chimie, le sel est un composé ionique constitué d'ions positifs (cations) et d'ions négatifs (anions), formant un composé neutre (sans être chargé). Le sel est formé à partir de la réaction d'acides et de bases. Le sel peut également être formé à partir de deux sels différents tels que:
Pb (NO 3 ) 2 (aq) + Na 2 SO 4 (aq) → PbSO 4 (s) + 2 NaNO 3 (aq)
3. Réaction de corrosion
La corrosion est le dommage au métal dû à la réaction redox entre un métal et diverses substances dans son environnement qui produisent des composés indésirables.
Dans le processus de corrosion, le fer (Fe) agit comme un agent réducteur et l'oxygène (O2) dissous dans l'eau agit comme un oxydant. L'équation de réaction pour la formation de rouille est la suivante:
Fe ( s ) → Fe2 + ( aq ) + 2e–
O 2 ( g ) + 4H + ( aq) + 4e– → 2H 2 O ( l )
4. Réactions de photosynthèse
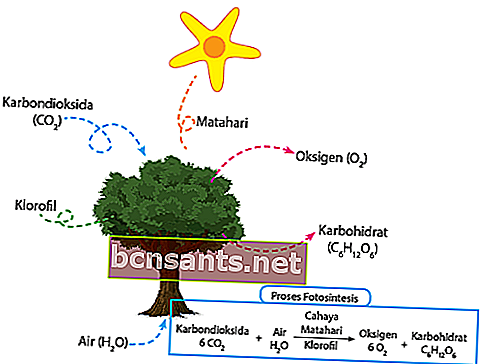
Selon KBBI, le processus de photosynthèse est une plante verte qui utilise la lumière du soleil pour convertir l'eau et le dioxyde de carbone en hydrates de carbone. Le dioxyde de carbone qui se trouve autour de la plante est directement absorbé par le tissu stomate des feuilles. L'eau qui se trouve autour de la plante est directement absorbée par les racines et transmise aux feuilles par les tiges de la plante.
Dès midi, l'intensité lumineuse qui diminue est directement captée par la chlorophylle pour la photosynthèse. L'énergie solaire captée plus tôt convertira directement l'eau en oxygène et en hydrogène.
Enfin, l'hydrogène produit sera directement associé au dioxyde de carbone pour produire de la nourriture pour les besoins de ces plantes. Le reste, l'oxygène sera libéré directement dans l'air par les stomates. Voici l'équation chimique:
6CO2 + 6H2O + lumière = C6H12O6 + 6O2
5. Réactions chimiques du vinaigre et du bicarbonate de soude
Vous a-t-on déjà parlé de la réaction chimique si le vinaigre et le bicarbonate de soude peuvent provoquer une éruption de volcan jouet dans votre école?
Les composés acides mélangés à des composés alcalins produiront des composés neutres. Dans l'expérience, un composé d'acide faible a été mélangé dans une solution d'acide acétique (CH3COOH) avec un composé de base forte dans une solution de bicarbonate de soude (NaHC03).

Dans une réaction chimique, une ou plusieurs substances peuvent être converties en nouvelles substances, selon l'expérience, le vinaigre acide (CH3COOH) est mis à réagir avec du bicarbonate de soude (NaHCO3) pour produire du CO2 gazeux.
Si le vinaigre acide (CH3COOH) et le bicarbonate de soude (NaHCO3) sont mis à réagir, cela produira des bulles qui provoquent la formation de gaz carbonique (CO2). Ces gaz et liquides feront sortir des liquides tels que la lave.
6. Réactions chimiques enzymatiques
Les enzymes sont des biomolécules sous forme de protéines qui fonctionnent comme des catalyseurs (composés qui accélèrent le processus de réaction sans réagir complètement) dans une réaction chimique organique.
Bien que le composé catalytique puisse changer dans la réaction initiale, dans la réaction finale, les molécules de catalyseur reviendront à leur forme d'origine. Les enzymes fonctionnent en réagissant avec les molécules de substrat pour produire des composés intermédiaires par une réaction organique qui nécessite une énergie d'activation plus faible, de sorte que les réactions chimiques s'accélèrent car les réactions chimiques avec des énergies d'activation plus élevées prennent plus de temps.
Par exemple: l'enzyme catalase est une enzyme qui catalyse une réaction dans laquelle le peroxyde d'hydrogène est décomposé en eau et oxygène.
