Une solution est un mélange homogène composé de deux substances ou plus, tandis que la solubilité est la quantité maximale d'un composé ou d'une substance qui peut se dissoudre dans un certain nombre de solvants .
Bon nombre des différentes solutions que nous rencontrons dans la vie quotidienne comprennent un verre de sirop sucré. Dans un verre de sirop, il y a plusieurs composants, à savoir l'eau, le sirop et le sucre.
Si ces composants sont mélangés ensemble jusqu'à ce que les composants constitutifs ne soient plus visibles, cela devient une solution.
En discutant de la solution, l'examen supplémentaire suivant comprend la définition, les propriétés, les types et les facteurs de la solution.
Définition de la solution et de la solubilité

Solution
Une solution est un mélange homogène constitué de deux substances ou plus. Appelé une solution en raison des composants de la solution.
Dans une solution, il y a des solvants et des solutés. Le soluté (soluté) est une substance qui constitue une solution qui a une plus petite quantité dans une solution. Pendant ce temps, le solvant (solvant) est une substance plus abondante que le soluté.
La composition de la substance marine en solution est exprimée par la concentration de la solution. Alors que le processus de mélange d'un soluté et d'un solvant pour former une solution est appelé dissolution ou solvatation.
Pour en savoir plus sur la solution, considérez l'image d'illustration suivante.
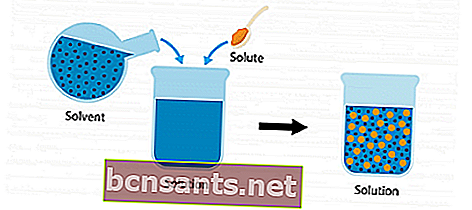
Il y a un soluté et un solvant. Lorsque les deux ingrédients sont mélangés et combinés dans un récipient, cela devient une solution.
Solubilité (s)
La signification de la solubilité est la quantité maximale d'un composé ou d'une substance qui peut se dissoudre dans un certain nombre de solvants.
La solubilité est symbolisée par s (solibilité) en unités mol / L ou utilise couramment des unités de molarité M. Voici la formule de solubilité ou molarité.
M = n / V
où M est la molarité (mol / L), n est le nombre de moles de la substance (mol) et V est le volume de la solution ou du solvant (L).
La solubilité est également définie comme la concentration d'une substance qui peut encore se dissoudre dans une certaine quantité de solvant.
Produit de solubilité constante (Ksp)
Un soluté dissous dans un solvant formera une réaction d'équilibre. L'apparition de l'équilibre est influencée par les solutés insolubles et les ions solutés.
Lisez aussi: plus de 100 exemples de mots standard et non standard + explicationsCe qui suit est un exemple de la constante d'équilibre pour une réaction.
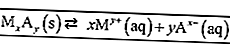
Conformément aux règles d'écriture de la formule d'équilibre, seules les substances sous forme de solution (aq) et de gaz (s) sont écrites dans la formule. Pour que:
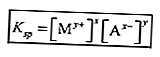
La constante d'équilibre d'une solution difficile à dissoudre est appelée constante du produit de solubilité (Ksp).
Propriétés de la solution

Les propriétés physiques qui apparaissent dans la solution sont divisées en trois, à savoir:
1. Propriétés colligatives des solutions
C'est une caractéristique de solution qui dépend du nombre de particules de soluté dans une solution et ne dépend pas du type de particules de solvant.
Les propriétés colligatives sont équivalentes à la concentration de diverses substances non électrolytiques en solution quels que soient le type ou les propriétés chimiques des constituants.
Dans la détermination des propriétés colligatives d'une solution de solides dans un liquide, le solide est considéré comme non volatil et la pression de vapeur au-dessus de la solution provient entièrement du solvant.
Certaines des propriétés colligatives d'une solution sont la pression osmotique, la diminution de la pression de vapeur, l'augmentation du point d'ébullition et la diminution du point de congélation.
2. Propriétés additives
En solution, les propriétés additives sont des propriétés d'une solution qui dépendent du nombre total d'atomes de la molécule ou du nombre de propriétés constitutives de la solution.
Un exemple des propriétés additives des solutions est le poids moléculaire, qui est la somme des masses atomiques.
La masse des composants d'une solution est incluse dans les propriétés additives, la masse totale de la solution est la quantité de chaque composant de la solution, à savoir le soluté et le solvant.
3. Nature constitutive
Cela inclut la nature de la solution qui dépend des atomes de la molécule (du type d'atome et du nombre d'atomes). Ses propriétés constitutives indiquent les règles de composés uniques et de groupes de molécules dans le système.
Il existe plusieurs propriétés physiques qui sont en partie additives et constitutives. Parmi eux, il y a la réfraction de la lumière, les propriétés électriques, les propriétés de surface et inter-surfaces qui sont incluses dans certains additifs constitutifs et certains.
Type de solution

1. Solution non saturée
Une solution insaturée signifie une solution qui contient moins de soluté que nécessaire pour faire une solution saturée. Les solutions insaturées contiennent des particules qui n'ont pas réagi correctement avec la substance, en d'autres termes, elles peuvent encore dissoudre la substance.
La solution est dite insaturée lorsque la valeur de concentration ionique <Ksp. Dans une solution insaturée, il n'y a pas de dépôt de soluté.
Lire aussi: Définition des solutions chimiques et de leurs types et composants2. Solution saturée
Une solution est incluse dans une solution saturée lorsqu'il y a un équilibre entre le soluté et le solvant. Dans une solution saturée, les particules réagissent exactement avec le réactif ou subissent une concentration maximale.
La solution est dite saturée si la concentration ionique est la même que la valeur Ksp. Dans cette condition d'équilibre, la vitesse du soluté dans le solvant est la même que la vitesse à laquelle il se dépose. Autrement dit, la concentration de la substance dans la solution est la même.
3. Solution hautement saturée
C'est une solution qui contient plus de soluté que le solvant. Cela provoque la valeur du produit de concentration ionique> Ksp de sorte que la solution est saturée et se dépose.
Facteur de solubilité

La solubilité d'un liquide varie. Ceci est influencé par plusieurs facteurs de solubilité. Voici quelques-uns des facteurs de solubilité.
1. Température
Le niveau de température de la solution affecte le processus de dissolution du soluté. À des températures plus élevées, le soluté se dissoudra facilement dans le solvant.
Cela se produit parce que les particules solides à des températures plus élevées se déplacent plus rapidement, ce qui permet des collisions plus fréquentes et efficaces.
2. La taille du soluté
Plus les granules de soluté sont petits, plus ils se dissoudront facilement dans le solvant. La petite quantité de granules de soluté fait que la surface de la substance est plus large et étalée dans une solution.
Plus la surface de la substance est grande, plus les particules se heurtent les unes aux autres. C'est ce qui accélère le processus de dissolution.
3. Volume de solvant
Le volume important du solvant affecte le processus de dissolution de la substance. En effet, de plus en plus de particules de solvant réagissent avec le soluté.
Plus le volume de solvant utilisé est élevé, plus le processus de dissolution du soluté sera rapide.
4. Vitesse de mélange
Le processus de dissolution sera plus rapide si vous ajoutez le facteur d'agitation.
Par agitation, les particules de soluté sont de plus en plus mélangées avec le solvant de sorte que la réaction de dissolution est plus rapide que de dissolution sans agitation.
Ceci est une explication de la solution et de la solubilité ainsi que de la signification, des propriétés, des types et des facteurs. Peut être utile.
