
Le système périodique des éléments est un arrangement qui représente les éléments chimiques. Habituellement, le système périodique d'éléments est organisé sous forme de tableau.
La disposition du système périodique des éléments est basée sur les numéros atomiques, les configurations électroniques et les propriétés chimiques.
Voici la disposition du système périodique des éléments:
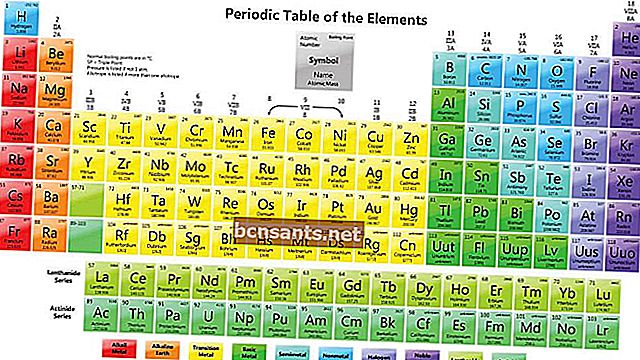
Comment lire les éléments dans le système périodique des éléments
Chez SPU, vous trouverez l'écriture de chaque élément comme indiqué ci-dessous.
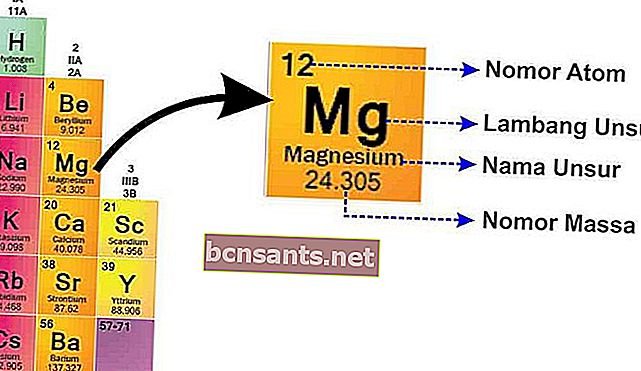
De cette image, il peut expliquer:
- Nombre de masse
Le nombre de masse est le noyau de l'atome qui a une charge positive car il y a des protons chargés positivementet neutrons qui sont neutres
- Numéro atomique
Le numéro atomique vous indique le nombre de protons, car l'atome est neutre, le numéro atomique vous indique également le nombre d' électrons .
Regroupement d'éléments
Dans le système périodique des éléments, chaque élément est groupé en conséquence
- Groupe
Les groupes sont dans la colonne verticale du tableau du système périodique des éléments. Les éléments qui sont dans le même groupe auront la même configuration d'électrons de valence.

- Période
Les périodes sont les éléments qui se trouvent sur une ligne horizontale dans le tableau périodique des éléments. La période montre l'énergie d'ionisation , le rayon atomique, l'affinité électronique et l' électronégativité.

- Bloquer
Un bloc représente une collection d'éléments qui ont la même sous-couche d'électrons de valence.

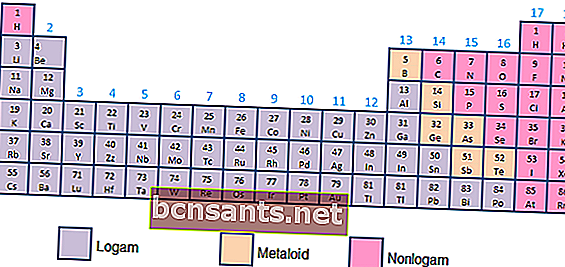
- Métaux, métalloïdes et non-métaux
Sur la base de leurs propriétés chimiques et physiques, les éléments peuvent être classés en métaux (conductivité élevée), métalloïdes (conductivité entre métaux et non-métaux) ou non-métaux (n'ayant pas de propriétés de conductivité, sous forme de gaz).
Énergie d'ionisation, rayon atomique, affinité électronique et électronégativité
L'énergie d'ionisation, le rayon atomique, l'affinité électronique et l'électronégativité peuvent être vus en fonction des périodes et des groupes d'éléments dans le système élémentaire.
Lisez aussi: Comment identifiez-vous les corps des victimes d'accidents d'avion?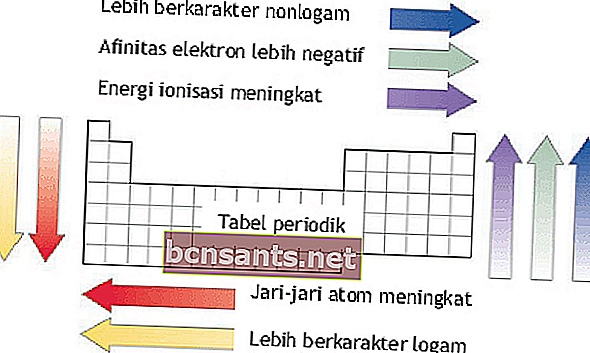
Énergie d'ionisation
L'énergie d'ionisation est l'énergie nécessaire pour éliminer l'un des électrons externes d'un atome à l'état gazeux.
En une période, l'énergie d'ionisation augmente de gauche à droite à mesure que le numéro atomique augmente.
Au sein d'un groupe, les énergies d'ionisation diminuent de haut en bas à mesure que le numéro atomique augmente.
Rayon atomique
Le rayon atomique est la distance entre le noyau atomique et la trajectoire la plus externe de l'atome.
En une période, le rayon atomique augmente de haut en bas.
Au sein d'un groupe, le rayon atomique augmente de droite à gauche.
Affinité électronique
L'affinité électronique est l'énergie libérée par un atome à l'état gazeux pour former des ions négatifs.
En une période, l'affinité électronique augmente de bas en haut. Au sein d'un groupe, l'affinité électronique augmente de gauche à droite.
Électronégativité
L'électronégativité est la valeur de la tendance d'un atome à attirer les électrons lors de la formation de liaisons chimiques. Cette propriété est importante dans la formation de liaisons entre les atomes.
En une période, l'électronégativité augmente de bas en haut.
En une période, l'électronégativité augmente de gauche à droite.
Référence
- Tableau périodique des éléments
- //www.studiobelajar.com/sistem-periodic-elements/
